Advanced Functional Materials | 临港实验室构建肿瘤靶向脂质体共载NFS1抑制剂和顺铂改善耐药结直肠癌治疗效果
结直肠癌(CRC)在全球癌症中发病率排名第三,死亡率排名第二,严重危害人类健康。目前,化疗仍是CRC切除术后的主要治疗手段,代表性药物包括顺铂(CP)和奥沙利铂等铂类药物。然而,多种耐药机制导致CRC对CP治疗的化疗敏感性降低,进而加大药量引起全身系统性毒性。因此,克服铂类药物耐药,同时最大限度地减少全身毒性仍是临床CRC治疗亟待解决的难题。联合用药为克服肿瘤耐药提供了一种有效策略。半胱氨酸脱硫酶(NFS1)抑制剂(NI)可通过抑制NFS1活性来放大氧化应激,有效触发肿瘤细胞发生泛凋亡(PANoptosis),与CP协同杀伤耐药肿瘤细胞。然而,系统联合给药后,CP和NI的非特异性生物分布会引发全身毒性;二者的不同理化性质也会阻碍其协同递送。构建具有肿瘤靶向性的纳米递送系统为两药协同包载并共递送提供了解决途径。
2025年10月16日,临港实验室郎天群团队联合王锦政团队在国际学术期刊Advanced Functional Materials上发表题为“Inhibiting NFS1 by Targeting Liposomes for Combating Cisplatin-resistant Colorectal Cancer”的研究论文。该研究构建了一种D18多肽修饰的脂质体(DLP),该脂质体共负载顺铂和半胱氨酸脱硫酶抑制剂以实现结直肠肿瘤靶向递药并有效杀伤耐药肿瘤。

在本研究中,为提高肿瘤靶向性,研究人员开发合成了D18肿瘤靶向多肽,其可高效且稳定地修饰于共载CP和NI的脂质体表面。静脉系统给药后,脂质体结构保护两种药物不被提前清除,通过D18多肽与CRC表面Glypican-3的相互作用,DLP能够主动靶向并蓄积于结直肠肿瘤部位。
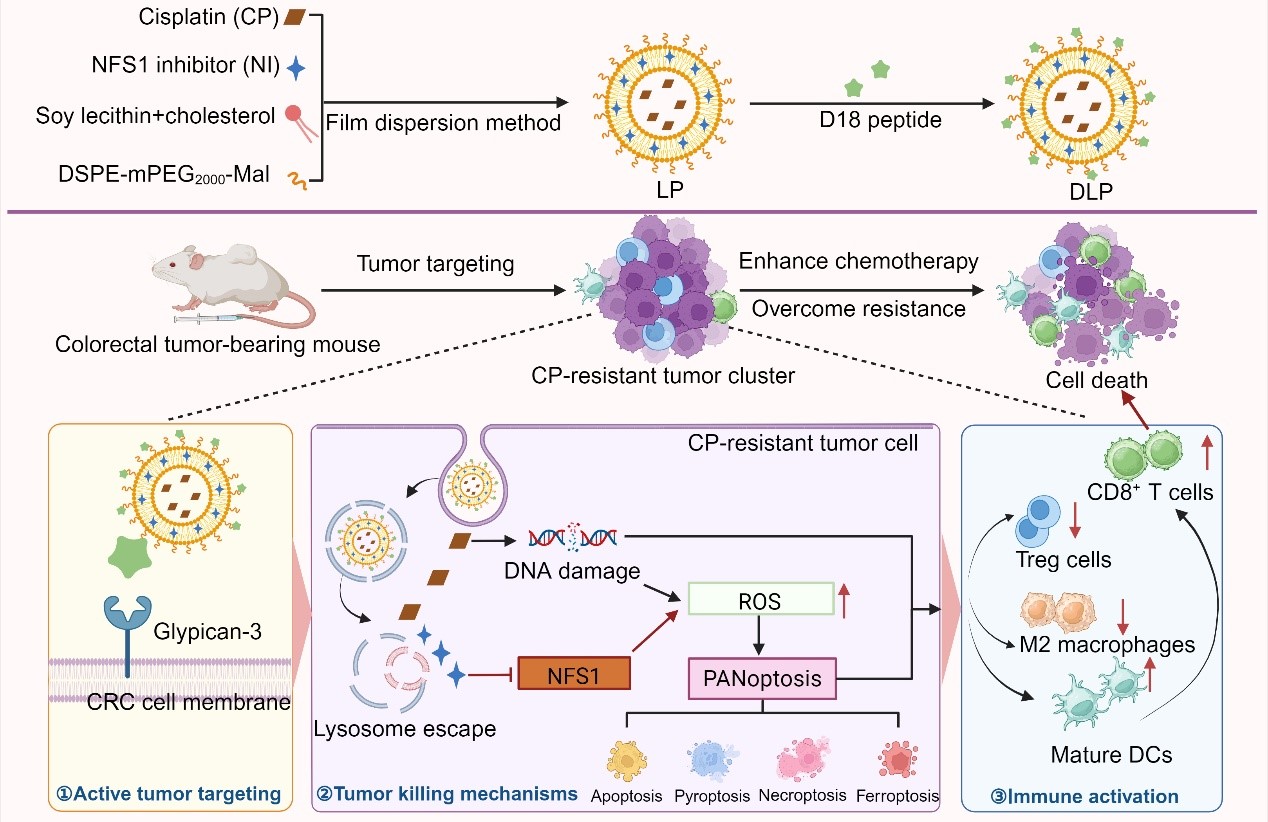
图1. DLP构建及其克服顺铂耐药的抗肿瘤机制示意图
研究表明,在CT26荷瘤小鼠模型中,DLP在肿瘤组织中的蓄积药量约为游离药物组的6.56倍,显著降低了脱靶毒性,并解决了不同理化性质药物共递送的难题。到达肿瘤部位后,DLP能够被肿瘤细胞有效摄取,其整合靶向递送与免疫激活以对抗CP耐药肿瘤。通过抑制NFS1活性,上调活性氧(ROS)水平,DLP诱导包括细胞凋亡,细胞焦亡,细胞坏死和铁死亡在内的多种类型的细胞损伤发生,进而刺激DCs成熟、激活CD8+ T细胞、减少M2型肿瘤相关巨噬细胞和调节性T细胞(Tregs)等免疫抑制性细胞浸润比例,最终增强CP化疗敏感性,逆转肿瘤耐药。DLP对CT26荷瘤小鼠的抑瘤率为84.1%;对于CP耐药HCT116-CP荷瘤裸鼠,DLP组的抑瘤率达85.3%,比游离CP组提高了38.9%。
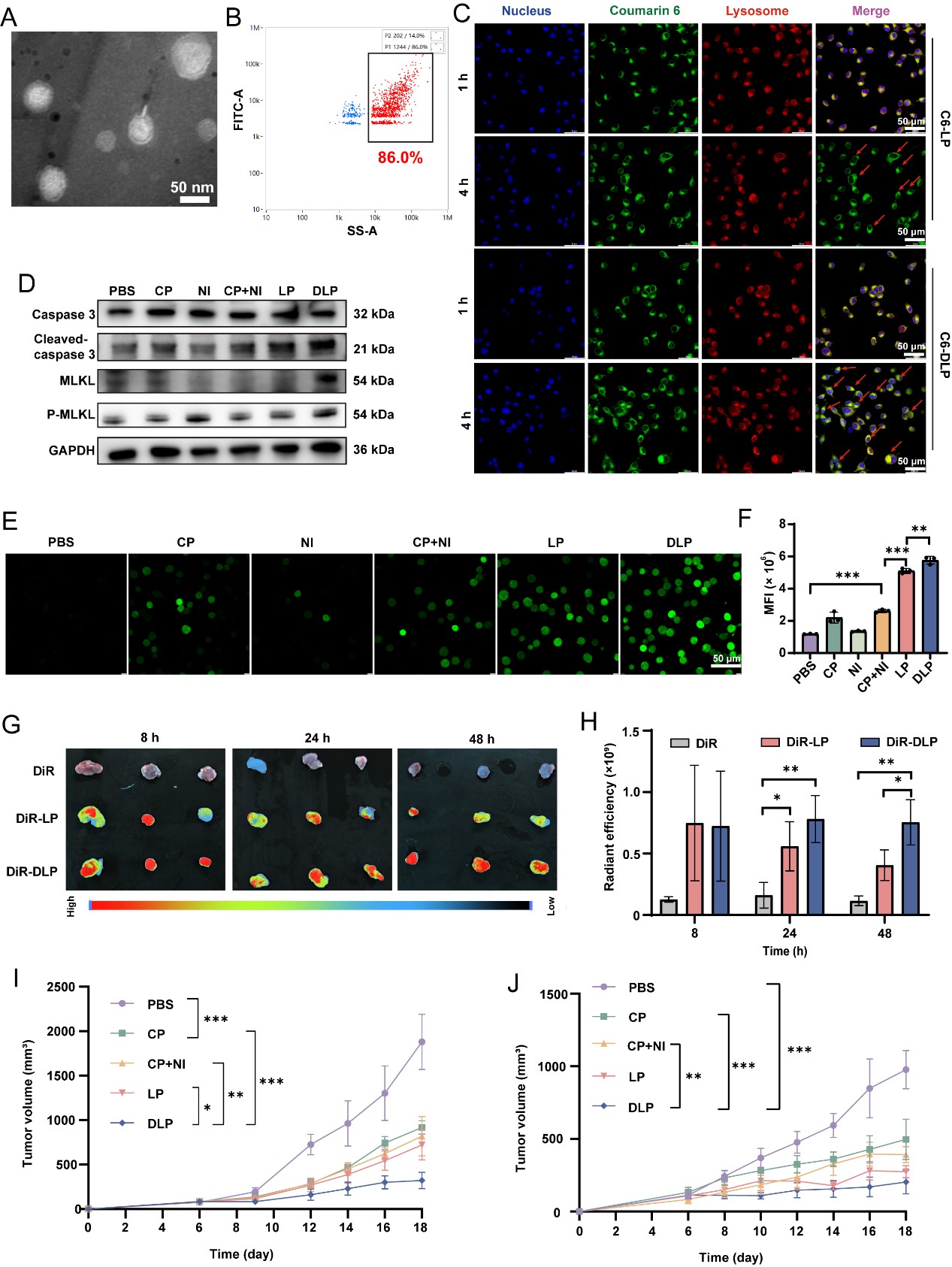
图2. DLP表征及改善耐药结直肠癌治疗效果
(A)透射电镜图:DLP形貌;(B)纳米流式检测:多肽修饰脂质体效率;(C)共聚焦显微镜图片:CT26肿瘤细胞中,DLP溶酶体共定位与逃逸;(D)CT26细胞部分PANoptosis相关蛋白表达水平;(E-F)细胞内ROS定性与定量分析;(G-H)CT26荷瘤小鼠体内肿瘤靶向性考察;(I)CT26荷瘤小鼠肿瘤生长曲线;(J)HCT116-CP荷瘤裸鼠肿瘤生长曲线。
综上所述,研究团队构建了肿瘤靶向脂质体DLP,通过上调ROS诱导肿瘤细胞发生PANoptosis,增强顺铂化疗敏感性,抑制CP耐药CRC的生长。该系统的靶向联合策略为改善CP耐药CRC的治疗提供了新思路和重要参考。
临港实验室郎天群青年研究员、王锦政青年研究员为论文的共同通讯作者。临港实验室与上海科技大学联合培养博士生邵欣悦,科研助理侯加珍为论文的共同第一作者。该研究得到了临港实验室、上海市“超级博士后”、上海市科委“扬帆计划”等项目的资助。
附件下载:



