Trends In Biochemical Sciences | 临港实验室合作研究:探索稳定蛋白-蛋白相互作用的非降解型分子胶
蛋白质-蛋白质相互作用(PPIs)构成了细胞生命活动的基本网络,是信号传导、转录调控、代谢控制等过程的关键环节。长期以来,PPIs 被认为是“难以成药”的领域:其作用界面通常平坦且缺乏明确的小分子结合口袋,传统抑制剂开发面临巨大挑战。然而,随着靶向蛋白降解(TPD)策略的兴起,研究者们发现可以通过“化学邻近诱导”(chemical induced proximity)的方式来重塑或诱导特定的蛋白-蛋白相互作用,从而突破 PPI 成药性的传统限制。
近年来,基于E3连接酶的分子胶降解剂(MGDs)推动了TPD领域的迅猛发展,已有多个候选药物进入临床试验。相比之下,另一类不依赖降解机制的非降解型分子胶(non-degrading molecular glues)正逐渐崭露头角。它们不通过泛素-蛋白酶体途径,而是通过稳定和调控PPIs,进而影响蛋白复合物的装配、亚细胞定位以及信号通路调节,为复杂疾病的治疗开辟了新的思路。
近日,临港实验室陆文超团队联合华东理工大学张健教授在Cell Press旗下期刊Trends in Biochemical Sciences在线发表“Exploring non-degrading molecular glues for protein-protein interactions”的综述文章。 该综述系统总结了非降解型分子胶的作用机制和研究进展,重点介绍了FKBP12、环孢素A和14-3-3等经典“呈递蛋白”体系,同时结合新兴案例展示了该领域的快速发展。作者强调,化学生物学、结构生物学与计算辅助设计等学科的深度融合,正在推动非降解型分子胶的加速发现与应用。

一、非降解型分子胶:通过稳定PPI实现功能调控
蛋白质-蛋白质相互作用(PPIs)在细胞生物学过程中具有基础性地位,广泛参与信号转导、基因调控及酶活性调节。人类蛋白互作组包含超过数十万个潜在PPIs,构成了药物研发的重要靶标资源。近年来,化学邻近诱导(CIP,Chemically Induced Proximity)策略在靶向蛋白降解(TPD)领域取得了显著突破,尤其是通过PROTACs和分子胶降解剂(MGDs)实现对致病蛋白的高效清除。这些技术均依赖于泛素-蛋白酶体系统来实现降解功能。与此不同,非降解型分子胶代表了CIP策略的另一类新兴形式。这类分子通过稳定已存在或诱导新生(Neomorphic)的PPIs,在不激活E3连接酶或诱导泛素化的前提下,有效调控信号通路、蛋白定位及多蛋白复合物的组装与稳定。相关研究表明,非降解型分子胶因其独特的作用机制与特异性识别能力,在癌症等复杂疾病中展现出广阔的治疗潜力(图1)。
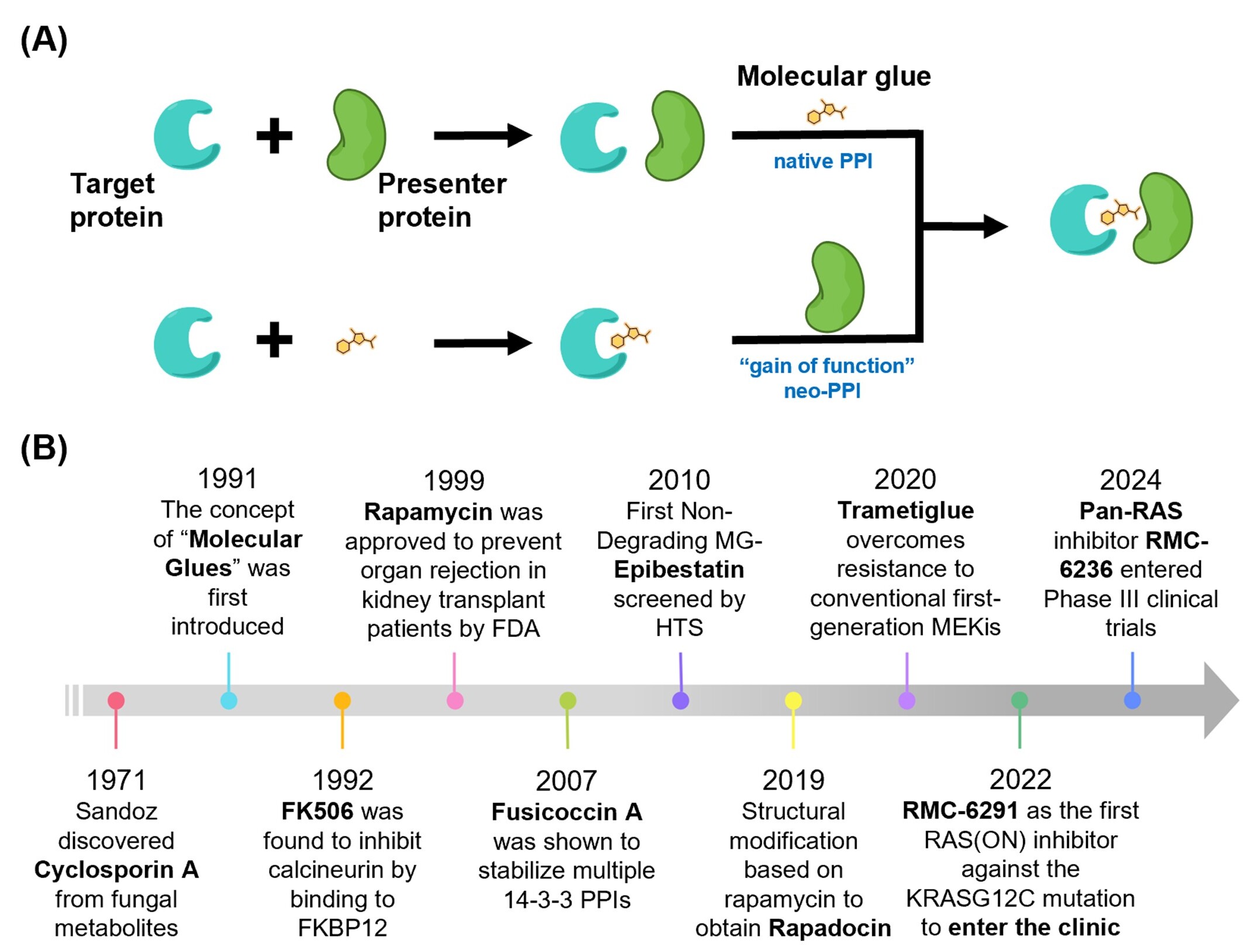
图1:非降解型分子胶作用原理及发展历程
二、免疫亲和蛋白与14-3-3蛋白:经典“呈递蛋白”平台
与降解型分子胶通常招募E3连接酶(如CRBN或VHL)作为“呈递蛋白”不同,非降解型分子胶更依赖 内源性支架蛋白(如免疫亲和蛋白和14-3-3蛋白)来介导靶蛋白之间的相互作用。这些支架蛋白作为“分子稳定器”,能够增强天然状态下本就微弱或瞬时的蛋白质-蛋白质相互作用,从而稳定复合物并调控功能。其中,免疫亲和蛋白(Immunophilins) 与 14-3-3蛋白 是最具代表性的两类“呈递蛋白”:免疫亲和蛋白 是一类高度保守的胞内蛋白,最早作为免疫抑制剂(如FK506、雷帕霉素和环孢素A)的结合靶点而被发现。它们主要分为两个亚家族:结合FK506/雷帕霉素的 FKBPs,以及结合环孢素A的 Cyclophilins。受雷帕霉素和环孢素A诱导三元复合物机制的启发,Revolution Medicines 公司 开发出一类创新的 KRAS靶向“三元复合物”抑制剂,能够同时作用于突变型KRAS与Cyclophilin A(CYPA)。代表性分子包括:RMC-6291(靶向KRASG12C,NCT05462717);RMC-9805(选择性抑制KRASG12D 并调节肿瘤免疫微环境,NCT06040541);RMC-6236(Daraxonrasib,一种“泛RAS(ON)”分子胶抑制剂,目前已进入胰腺癌III期临床试验,NCT06625320)。这一系列成果充分展示了免疫亲和蛋白作为“分子胶支架”的巨大潜力(图2)。
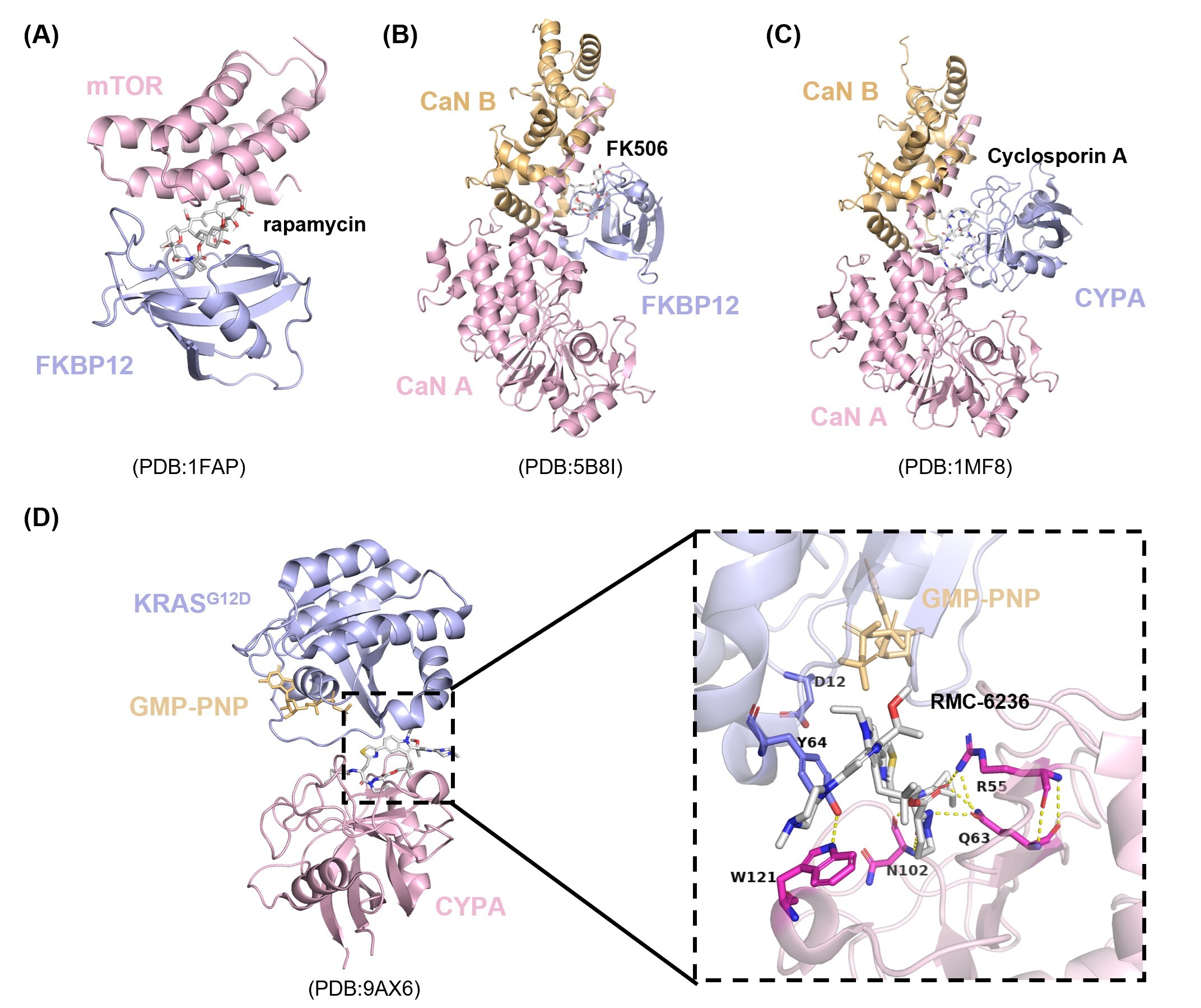
图2:通过FKBP12和CYPA作为呈递蛋白的非降解型分子胶
14-3-3蛋白 是另一类高度保守的调节型适配蛋白家族。它们能够识别超过300个靶标中的特定磷酸化丝氨酸或苏氨酸基序,从而稳定蛋白构象、防止降解、调控亚细胞定位,并促进多蛋白信号复合物的组装。在结构上,14-3-3蛋白以同源或异源二聚体形式存在(每个单体约30 kDa),其两亲性凹槽能够容纳多种经典结合基序,包括 RSXpSXP、RX(Y/F)XXpSXP 和 pS/pTX1–2–COOH 等(图3)。这一结构特征为设计和发现基于14-3-3的非降解型分子胶奠定了坚实基础。
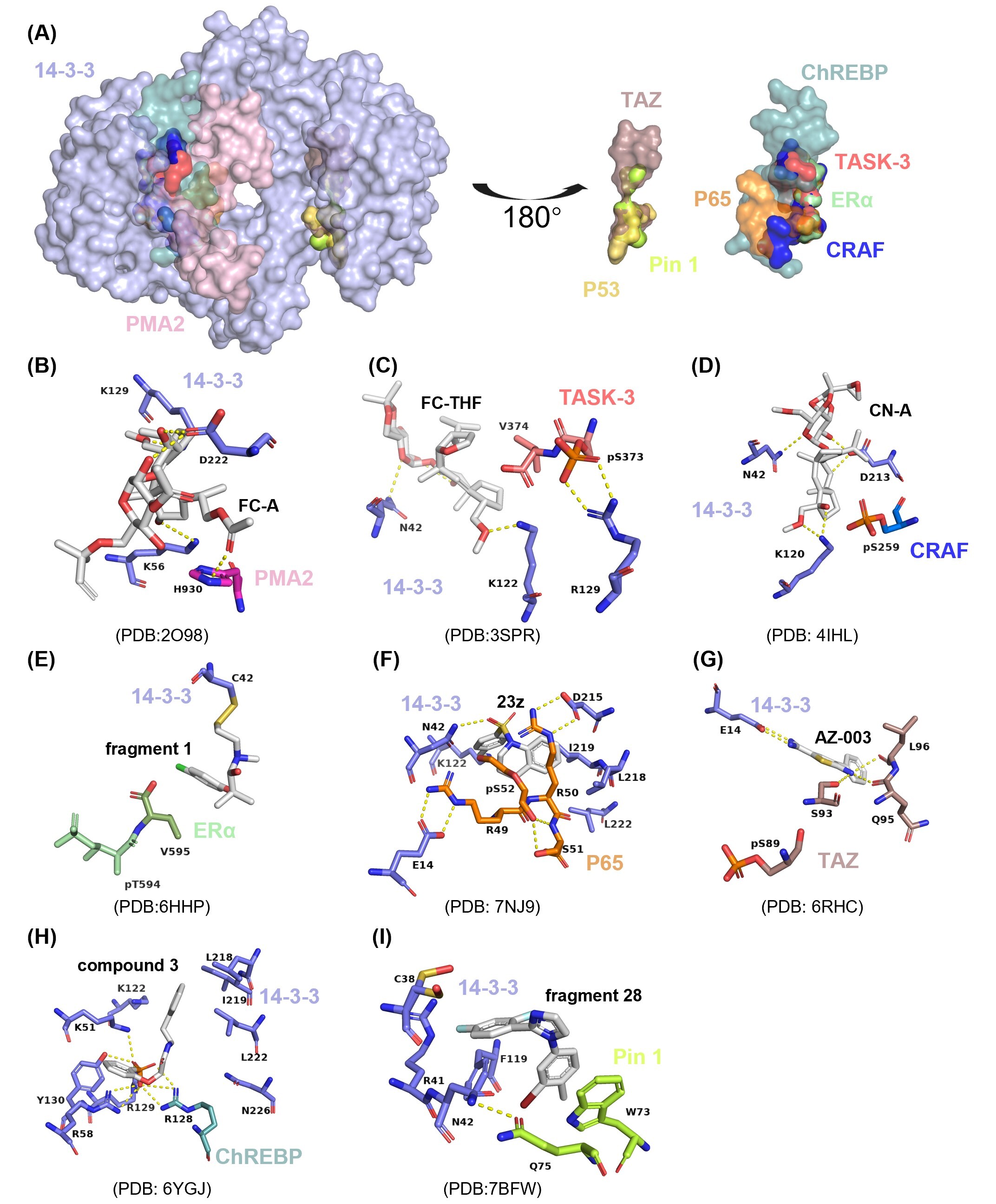
图3:基于14-3-3呈递蛋白的非降解型分子胶的复合物结构基础
三、新兴策略驱动非降解型分子胶的发现
在靶点导向的高通量筛选(HTS)和理性设计策略推动下,能够稳定蛋白质–蛋白质相互作用(PPIs)的分子胶不断涌现。与此同时,一系列新兴方法正在崛起,为非降解型分子胶的发现注入新的动力。DNA 编码化合物库(DEL)筛选极大拓展了可探索的化合物空间;亲和力筛选与片段化学库的结合提高了先导分子的发现效率;而共价片段筛选结合计算辅助设计,则进一步增强了复合物的稳定性。这些技术的出现逐步突破了传统 PPI 调控的瓶颈,使分子胶的发现过程不再依赖“偶然碰撞”,而是迈向更加可预测和可设计的阶段(图4)。
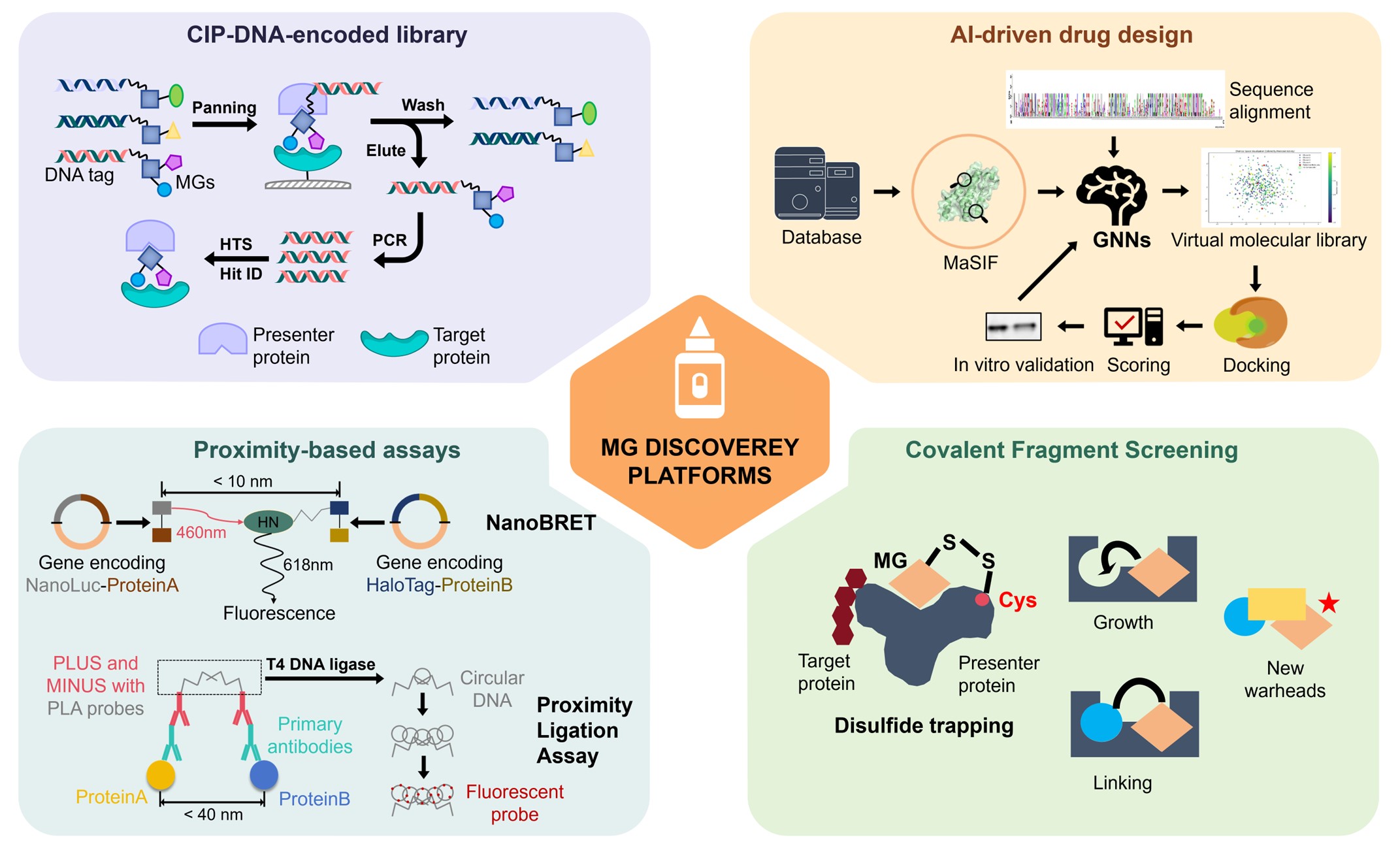
图4:快速发展的化学生物学工具开发整合提升了非降解型分子胶的发现效率
四、总结
非降解型分子胶通过稳定瞬时存在的PPIs实现蛋白功能调控,而非依赖降解途径,为药物研发提供了全新的思路。其作用机制具备更高的可控性与可逆性,特别适合剂量敏感或构象复杂的靶点。
尽管目前仍面临初始化学库有限、缺乏通用筛选平台等挑战,但随着人工智能、结构生物学与实验筛选技术的深度融合,这一领域正迎来加速发展的新机遇。未来,随着对PPI网络理解的进一步加深,非降解型分子胶有望在肿瘤、神经退行性疾病、感染性疾病等多个重大疾病领域发挥越来越核心的作用。
本研究由临港实验室陆文超团队与华东理工大学张健团队合作完成。陆文超青年研究员、张健副教授为共同通讯作者,临港实验室/华东理工大学2024级工程博专项一年级研究生喻斯彤为第一作者。该项工作得到了临港实验室专项项目的资助。
附件下载:



