同日两篇《自然·生物技术》,临港实验室联合开发新型线粒体碱基编辑器,首次实现线粒体致病突变体内原位纠正
线粒体作为半自主细胞器,其DNA(mtDNA)突变会导致组织和器官发生严重的功能障碍,成为线粒体遗传疾病、肿瘤、衰老发生发展的关键因素。据统计,全球约1/5000人因存在有害线粒体DNA突变而患病,其中最常见的包括Leber遗传性视神经病变(LHON)、乳酸酸中毒和中风样发作(MELAS)和Leigh综合征等。这些疾病发病于任何年龄,累及肌肉、心脏、大脑等全身多个器官,具有症状严重、治愈率低的特点。据统计,95%的mtDNA致病性突变均为点突变。尽管CRISPR/Cas衍生的碱基编辑器已广泛应用于核DNA(nDNA)点突变引起的遗传病治疗研究。但是由于线粒体特殊的结构,严重阻碍了sgRNA进入,因此CRISPR/Cas系统很难应用于线粒体基因组的操纵。
近年来,通过融合转录激活因子样效应子(TALE)、双链DNA的胞嘧啶脱氨酶DddA以及尿嘧啶糖苷酶抑制剂(UGI),David Liu/Joseph Mougous合作开发出线粒体胞嘧啶碱基编辑器DdCBE,实现了mtDNA的C到T编辑,Jin-Soo Kim团队通过替换UGI为腺苷脱氨酶TadA-8e开发出介导A到G编辑的线粒体腺嘌呤碱基编辑器TALEDs,线粒体A>G突变理论上可以分别模拟~45%和纠正~41%的致病性mtDNA点突变。高彩霞和魏文胜团队分别通过切口酶切开线粒体DNA形成单链,联合脱氨酶实现线粒体碱基转换。然而线粒体疾病发生通常依赖高频的mtDNA突变阈值(通常>50%)。当线粒体突变频率低于阈值时一般不会出现症状,因此,效率较低的线粒体碱基编辑系统难以获得具有表型的动物模型,纠正突变治疗疾病亦是如此。而当前线粒体碱基编辑器存在编辑活性、靶向精度等技术瓶颈,严重阻碍了难治性线粒体疾病模型的构建及根治性疗法的开发。此外尚无在动物水平直接原位纠正mtDNA致病突变从而实现线粒体疾病干预治疗的研究报道。
2025年6月3日,临港实验室陈亮团队联合华东师范大学李大力团队合作在Nature Biotechnology 期刊同一天发表了两篇研究论文,分别为:Efficient mitochondrial A-to-G base editors for the generation of mitochondrial disease models和A mitochondrial disease model is generated and corrected using engineered base editors in rat zygotes。研究团队通过TadA-8e的分子改造获得了一系列高活性、靶向范围更广的腺嘌呤脱氨酶变体,显著提升了nDNA和mtDNA腺嘌呤碱基编辑的靶向活性和靶向序列兼容性。高性能的线粒体腺嘌呤碱基编辑器(eTd-mtABEs)不仅展现了高效的编辑效率,并且保持低水平的DNA和RNA脱靶效应。利用eTd-mtABEs成功构建了感音神经性耳聋和Leigh综合症大鼠疾病模型,并使用重新改造的DdCBE变体首次实现线粒体致病突变的体内原位纠正,成功逆转了leigh综合征的疾病表型。


同期,针对上述研究Nature Biotechnology 期刊刊发了题为Base editors model mitochondrial disease的News & Views,以及题为Powering new therapeutics with precision mitochondrial editing的Editorial,高度评价上述两项工作。


在第一项工作中,研究团队推测腺嘌呤脱氨酶的活性是决定线粒体A>G编辑性能的关键因素之一,因此选择ABE8e作为起点,筛选新型TadA变体。通过定向进化腺苷脱氨酶TadA-8e,成功鉴定出高活性ABE变体A142W和A142R/L145W,相比于ABE8e,它们在非经典编辑窗口(A1-A3和A8-A11)活性平均提高了4.9倍和2.6倍,并且在ABE8e低效序列背景(非YAR motif)的编辑活性大幅度提高,拓宽了nDNA的靶向范围。
TadA-8e变体在核基因组编辑展现出的巨大优势,为开发出高性能的线粒体腺嘌呤碱基编辑工具提供可能性。之后,研究团队将高活性TadA变体引入sTALEDs中,获得超高活性的线粒体腺嘌呤碱基编辑工具(eTd-mtABEs)。相比于sTALEDs,eTd-mtABEs在多个线粒体内源靶点的编辑效率平均提高6.9倍,尤其是在原本编辑受限的RA序列背景下,分别提高了4.3倍和6.6倍,进一步的脱氨酶结构改造使得eTd-mtABEs兼具高效编辑能力和低水平的脱靶效应。TadA变体结合原先报道的切口酶策略,在不影响编辑精度的同时实现了更高效率的mtDNA链选择性编辑,平均提高了3.2倍。此外研究人员还观察到eTd-mtABEs在大鼠细胞系实现了高达145倍的效率提升,更为重要的是,在大鼠体内高效介导了致病性mtDNA点突变的引入,构建了感音神经性耳聋大鼠模型。
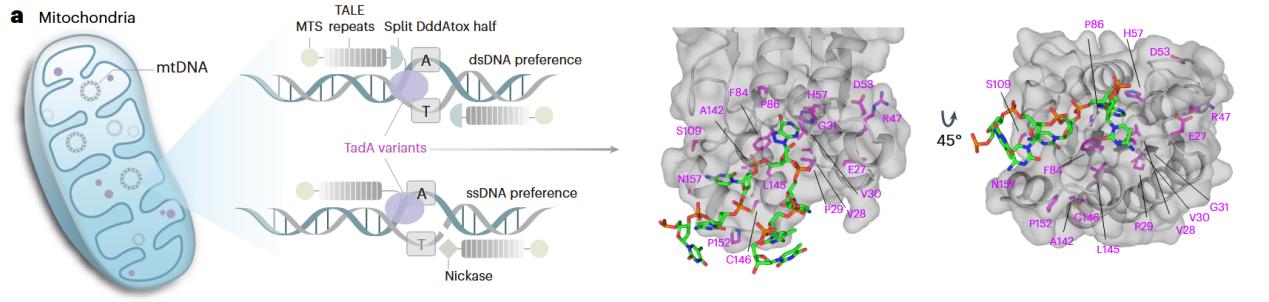
图1 eTd-mtABEs结构示意图
长期以来,线粒体疾病的治疗一直是医学领域内亟待攻克的难题。传统药物治疗价格昂贵,只缓解线粒体疾病所带来的部分症状,无法根治疾病,并且可能会带来极强的副作用,宝贵的mtDNA疾病动物模型和高精度线粒体基因编辑器是线粒体基础研究和基因治疗的重要技术支撑。
在同期发表的第二篇论文中,研究团队利用前一篇工作开发的线粒体腺嘌呤编辑器eTd-mtABE-RW/V28A在大鼠体内高效且精准的引入了Leigh综合征相关的致病性点突变,49只出生大鼠均携带近乎单个的致病性T>C编辑,平均效率高达54%,并且mtDNA点突变可以高效稳定的遗传,表型实验揭示了Leigh综合征大鼠产生明显的运动功能障碍和心脏功能受损,表明了Leigh综合征大鼠模型的成功建立。为实现该致病点突变(C7)的精准纠正,研究人员工程化设计并改造出60个DdCBE变体,最终获得大幅降低旁观者编辑的1333NC-DddA11-K1389A变体(编辑窗口为C7-C8),通过将最优的DdCBE变体注射到近乎纯合突变的大鼠受精卵中,实现了平均高达53%的野生型mtDNA恢复,高效精准的体内编辑使得Leigh综合征大鼠模型的肌肉和心脏功能改善至野生型大鼠水平。
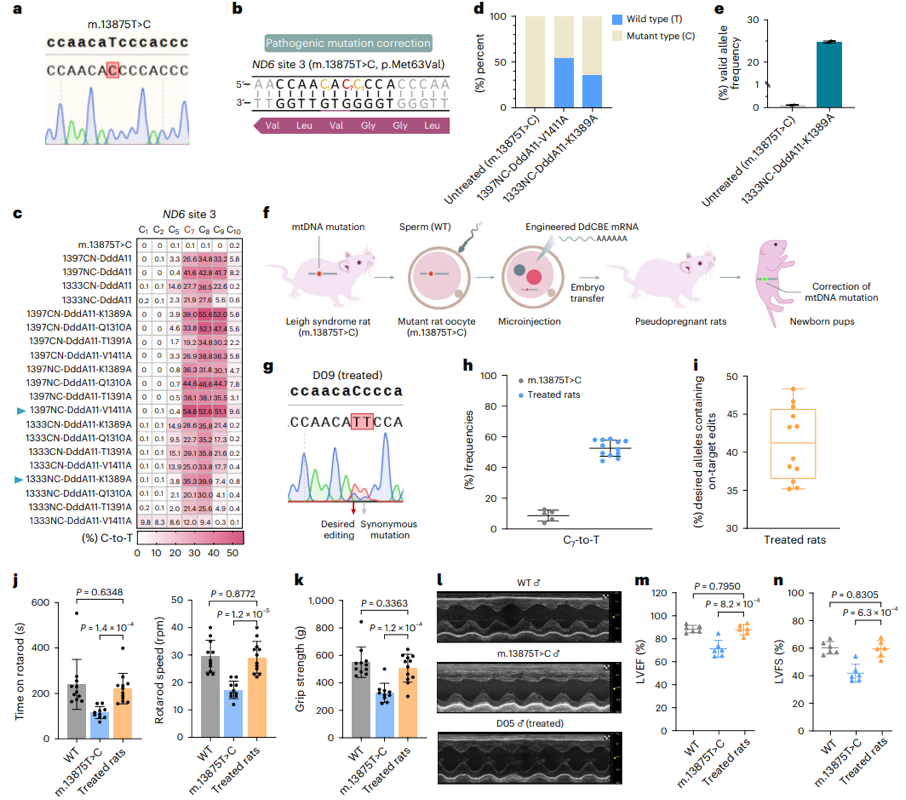
图2 基于改造的DdCBE实现体内原位纠正mtDNA致病性突变
总的来说,eTd-mtABEs是一个超高活性、低脱靶的新型线粒体腺嘌呤碱基编辑器,利用该工具可以实现快速的mtDNA疾病动物模型构建,为推进线粒体功能和疾病研究提供了强有力的工具;此外,研究团队应用升级版的高精度DdCBE变体实现了Leigh综合症的碱基编辑治疗,证明了基于线粒体基因编辑技术介导的mtDNA致病点突变原位纠正的可行性和有效性,这也为后续线粒体基因编辑器用于线粒体疾病的基因治疗研究提供了范式。
对于“Efficient mitochondrial A-to-G base editors for the generation of mitochondrial disease models”这项工作,临港实验室陈亮青年研究员、华东师范大学博士研究生洪梦佳、栾昌明为论文共同第一作者;对于“A mitochondrial disease model is generated and corrected using engineered base editors in rat zygotes” 这项工作,临港实验室陈亮青年研究员、华东师范大学博士研究生栾昌明、洪梦佳为论文共同第一作者;华东师范大学李大力研究员和临港实验室陈亮青年研究员为上述两篇论文通讯作者。北京大学魏文胜、伊宗裔给予了TALE模块构建方面的支持,华东师范大学刘明耀、高良才、周晓明在表型鉴定方面给予了支持。该研究得到了临港实验室、科技部国家重点研发计划/青年科学家项目、国家自然科学基金、上海尚思自然科学研究院、上海市基因编辑与细胞治疗前沿基地、中国科协“青年人才托举工程”项目、上海市东方英才计划青年项目等支持。
附件下载:



