Acta Biomaterialia | 临港实验室合作开发递送ROR1 siRNA前药纳米粒改善三阴性乳腺癌治疗效果
三阴性乳腺癌(Triple-negative breast cancer, TNBC)因其高复发、易转移、预后差及生存期短等特征,成为乳腺癌临床治疗的难点。受体酪氨酸激酶样孤儿受体1(Receptor tyrosine kinase-like orphan receptor 1, ROR1)在多种实体肿瘤中高度表达,包括乳腺癌、胰腺癌和肺癌等。目前,ROR1靶点开发方向包括单抗、双抗、ADC等,默沙东开发的ROR1 ADC药物(MK-2140)已进入三期临床试验,是目前进展最快的候选药物。小干扰RNA(Small interfering RNA, siRNA)能够特异性识别并水解同源信使RNA(Messenger RNA, mRNA),进而沉默目的基因表达;递送基于ROR1的siRNA成为治疗TNBC的潜在策略。然而,未经修饰的siRNA药物在血液循环中易被降解,不具备肿瘤靶向性且被肿瘤细胞摄取后内体逃逸困难,严重限制了其应用。因此,构建高效药物递送系统是开发抗肿瘤ROR1 siRNA的关键。
2025年1月1日,临港实验室郎天群研究团队联合中国科学院上海药物研究所李亚平团队在Acta Biomaterialia期刊发表题为“A Prodrug Nanodevice Co-delivering Docetaxel and ROR1 siRNA for Enhanced Triple Negative Breast Cancer Therapy”的研究论文。该研究合成化疗药物多西他赛(Docetaxel, DTX)前药载体(BLDP)和阳离子核酸载体(BDP),二者协同包载ROR1 siRNA,进而构建共递送DTX和ROR1 siRNA的前药纳米粒BBRM。

研究发现,BBRM在生理条件下稳定性良好,在溶酶体条件(pH 5.5)下,发生解体,实现药物响应性释放。在4T1细胞模型中,BBRM易被肿瘤细胞摄取并通过内体逃逸释放DTX及ROR1 siRNA,有效抑制ROR1表达,显著抑制肿瘤细胞增殖和转移。BBRM在小鼠体内具有长循环能力,药时曲线下面积较游离药物提高3.32倍,而血浆清除率减小82%。同时,在4T1肿瘤小鼠模型中,BBRM可被动靶向至肿瘤及肺组织,其肿瘤抑制率达74.1%,肺转移灶较游离DTX组减少78.6%。此外,BBRM能够诱导树突状细胞熟化、增强CD8+T细胞肿瘤浸润、促进IFN-γ等细胞因子分泌,进而逆转肿瘤免疫抑制微环境,提高抗肿瘤疗效。
综上所述,本研究基于前药策略和纳米技术,构建了一种靶向递送ROR1 siRNA的DTX前药纳米粒BBRM;为整合化疗及基于ROR1靶点的RNA干扰疗法用于改善TNBC治疗效果提供了一种潜在的策略。
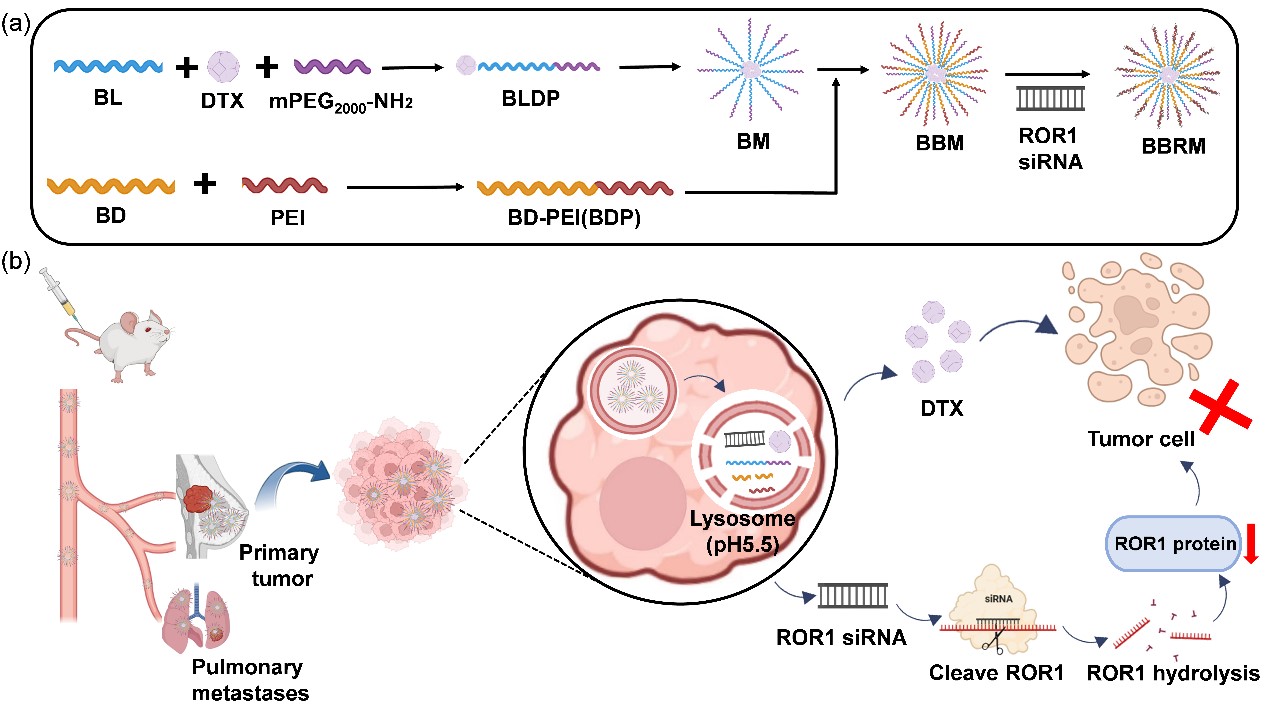
图1.BBRM联合化疗和RNA干扰疗法改善三阴性乳腺癌治疗效果
临港实验室郎天群青年研究员、中国科学院上海药物所李亚平研究员为论文的共同通讯作者。临港实验室与上海药物所联合培养硕士研究生、现临港实验室科研助理尹力玄为论文的第一作者。临港实验室为论文的第一完成单位。该研究得到了国家重点研发计划、临港实验室、上海市科委“扬帆计划”、上海市“超级博士后”等项目的资助。
附件下载:



