Cell Discovery|临港实验室合作揭示神经肽26RFa调控焦谷氨酰化RF酰胺肽受体的结构基础
RF酰胺肽受体属于A族G蛋白偶联受体(GPCR),因其配体为包含保守C末端RF-酰胺序列的神经肽而得名。在哺乳动物中,这类受体主要包括焦谷氨酰化RF酰胺肽受体(pyroglutamylated RF-amide peptide receptor,QRFPR/GPR103)、神经肽FF受体(NPFF1R/GPR147,NPFF2R/GPR74)、催乳素释放肽受体(PrRPR/GPR10)和kisspeptin受体(KISS1R/GPR54)。其中,内源神经肽26RFa通过激活QRFPR,刺激食欲,促进糖及骨质的代谢,从而调控人体能量稳态。靶向26RFa/QRFPR信号通路有望为治疗肥胖、糖尿病和饮食失调等代谢类疾病提供新的策略。然而,目前RF酰胺肽受体家族成员尚无结构被报道,QRFPR等受体的配体识别和受体调控机制仍不明确,限制了对这些受体配体识别机制的理解及靶向药物的发现。
2024年6月4日,临港实验室蒋轶研究团队联合中国科学院上海药物研究所谢欣、徐华强研究员团队在 Cell Discovery 在线发表了题为“Structural basis for recognition of 26RFa by the pyroglutamylated RFamide peptide receptor”的研究论文。

联合研究团队利用单颗粒冷冻电镜技术,解析了26RFa与QRFPR以及Gq蛋白复合物的结构(图1a)。该结构展示了26RFa与QRFPR独特的识别模式:QRFPR的胞外结构域与26RFa的氨基端螺旋形成广泛的相互作用,受体N端的两段短α螺旋与多肽氨基末端的螺旋区相扣(图1b),该结合模式区别于已报道的多肽类GPCR,且对多肽的特异性识别至关重要(图1c,d)。26RFa的羧基端七肽嵌入跨膜口袋与受体核心相互作用,调控受体的活化(图1b)。研究团队进一步通过结构比对、序列保守性分析及功能评价等手段,对RF酰胺肽家族成员高度保守的RF-NH2片段与受体识别的共性和差异性进行了结构和功能分析(图2),同时也对其与具有类似RY-NH2羧基末端的神经肽Y与受体的识别模式进行了对比分析(图3)。
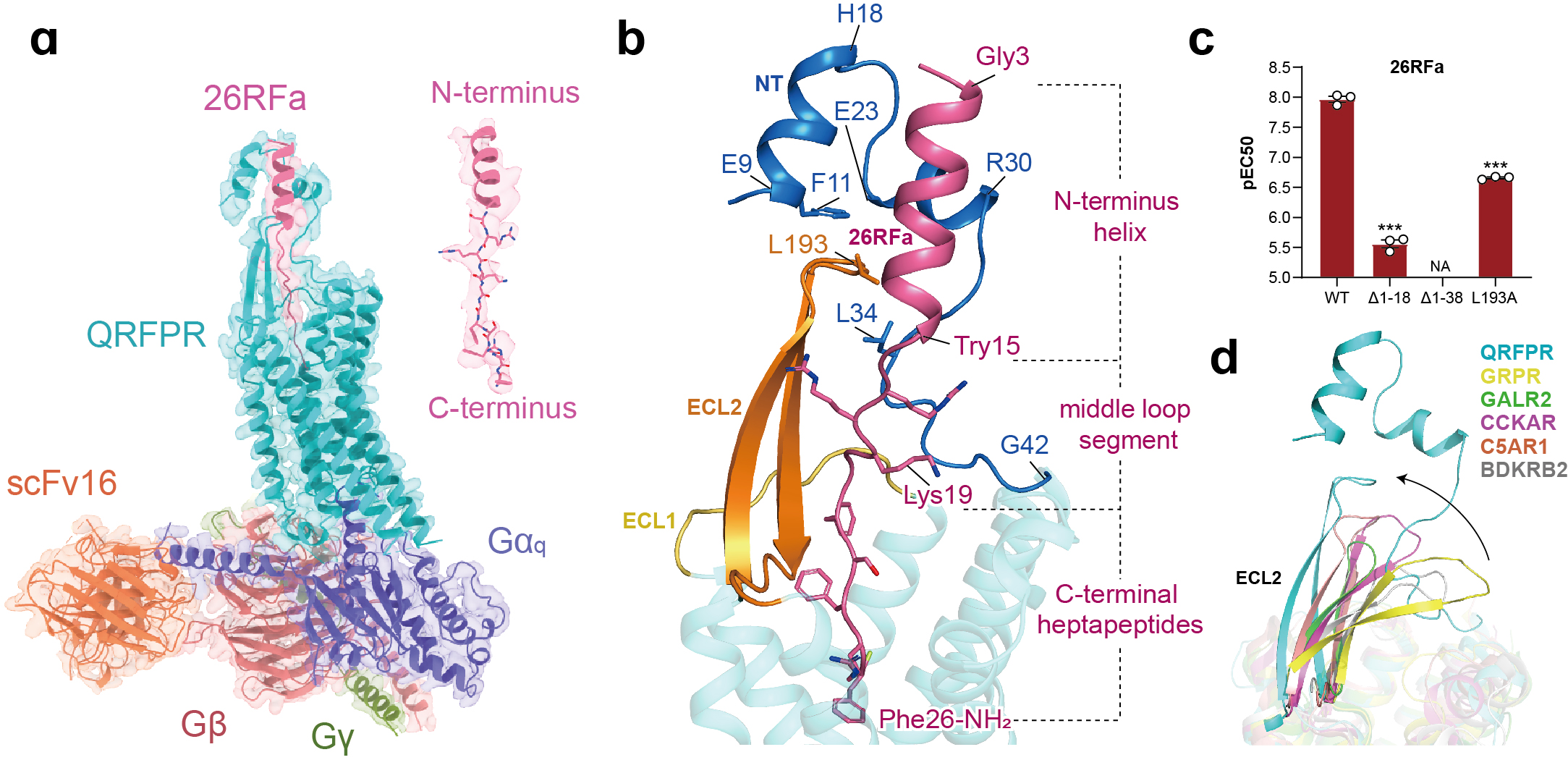
图1. 26RFa-QRFPR-Gq复合物的冷冻电镜结构
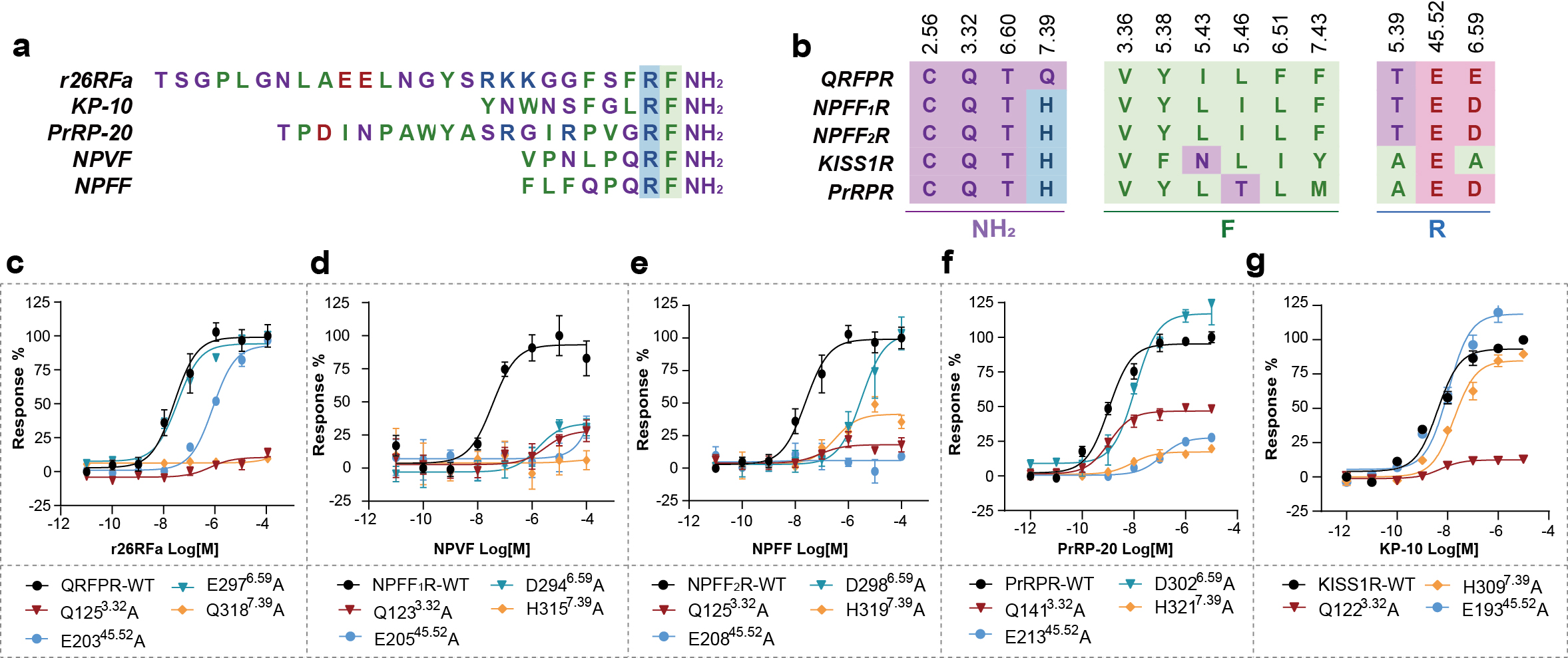
图2. RF酰胺多肽保守的RF-NH2片段与受体识别的共性和差异性分析
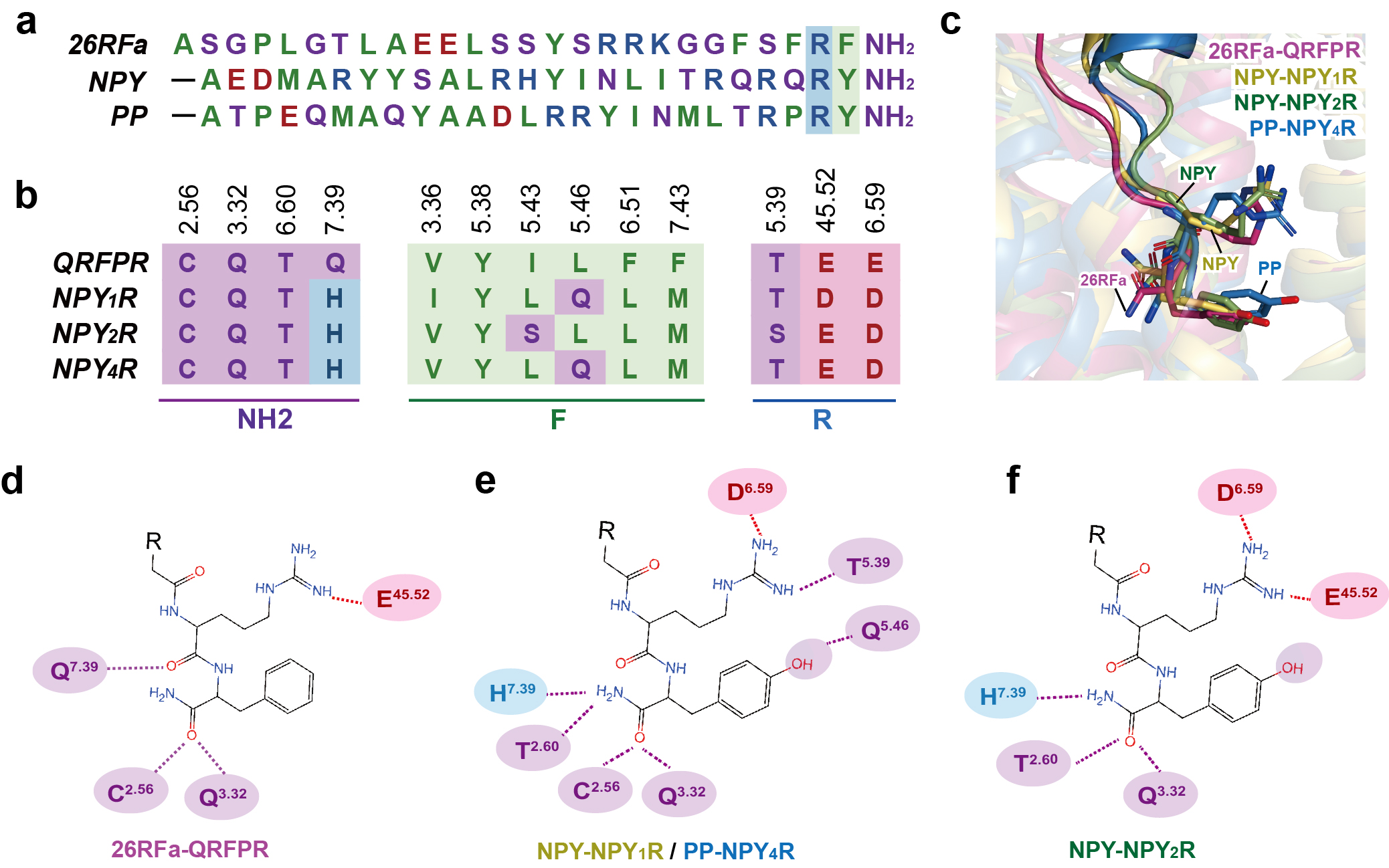
图3. 26RFa的RF-NH2与神经肽NPY的RY-NH2片段之受体结合模式比较
综上,该研究展示了首个RF酰胺肽家族受体的结构信息,不仅阐明了26RFa激活QRFPR的分子机制,同时揭示了整个RF-NH2/RY-NH2受体家族内源配体结合模式的规律,为理解QRFPR和其他RF酰胺肽受体家族的多肽调控过程和指导靶向药物设计奠定了重要的结构基础。
临港实验室研究员蒋轶、中国科学院上海药物研究所研究员谢欣、徐华强为该论文的共同通讯作者。临港实验室科研助理金三珊、中国科学院上海药物研究所博士后郭世猛、副研究员徐有伟、博士生李鑫和副研究员吴灿荣为该论文的共同第一作者。该成果获得了科技部、基金委和上海市等项目的支持。
附件下载:



