EMBO J | 临港实验室合作揭示血管周细胞调控血管和肿瘤微环境的分子机制
血管网络由血管内皮细胞以及包裹在外侧的壁细胞(包括大血管外侧的血管平滑肌细胞以及毛细血管外侧的周细胞)构成。研究表明,血管不仅仅是血液流动的通道,它们还能够分泌多种细胞因子和趋化因子,这些因子在调节肿瘤的休眠、增殖以及影响肿瘤免疫微环境中发挥着重要作用。同时,周细胞具有高度的可塑性,除了维护血管结构,还可以通过调节肿瘤免疫微环境,转分化为其他细胞,如成纤维细胞,从而为肿瘤的侵袭和转移创造条件。由于一氧化氮(NO)和其受体可溶性鸟苷酸环化酶(sGC)在血管内皮细胞和平滑肌细胞互动中起关键作用,研究发现sGC在肺部血管周细胞中的表达有助于修复受损血管网络,减少免疫细胞渗透,降低肺部损伤。然而,sGC在肿瘤周细胞中的作用尚不明确,其通过调节NO-sGC信号通路是否影响肿瘤微环境的功能尚待研究。
2024年3月25日,临港实验室魏武研究团队联合中国科学院上海有机化学研究所生物与化学交叉研究中心胡军浩课题组在The EMBO Journal上发表题为“Pericyte signaling via soluble guanylate cyclase shapes the vascular niche and microenvironment of tumors”的研究论文。该研究发现特异性敲除周细胞中的sGC会破坏周细胞与内皮细胞间的相互作用,导致周细胞与内皮细胞发生广泛地转录重编程,并进一步通过旁分泌的方式影响肿瘤中的成纤维细胞(CAFs)和巨噬细胞(TAMs)功能。利用药物抑制周细胞sGC可以显著提高肿瘤对于抗血管新生治疗的响应,为临床上提高靶向肿瘤血管的治疗效果提供了新的联合用药思路。

在本研究中,研究人员特异性敲除了周细胞中的sGC后,观察到小鼠肿瘤生长受到抑制。进一步分析发现,血管结构和功能受损,具体表现为血管密度降低、周细胞脱落增多、血管渗漏增加、血管灌注受损,这些改变导致肿瘤缺氧现象严重。进一步对肿瘤进行单细胞测序发现,肿瘤中细胞间相互作用受到显著影响,尤其是血管微环境中介导的内皮细胞与周细胞之间互作的Notch信号通路显著被抑制,使周细胞和内皮细胞发生转录重编程。进一步的机制研究发现,受损的血管微环境导致旁分泌的TGFβ信号通路相关的表达下调,而MIF信号通路相关的表达上调,从而导致CD105阴性的CAFs数量显著增多,以及肿瘤内的TAM发生了一部分M2-like向M1-like的极化转变。最后,研究人员通过应用VEGFR抑制剂呋喹替尼与sGC抑制剂ODQ联合治疗小鼠肿瘤,确认了ODQ可以破坏内皮细胞与周细胞的互作,进而增加血管内皮细胞对呋喹替尼的敏感性,极大的提高了呋喹替尼的肿瘤抑制效果。
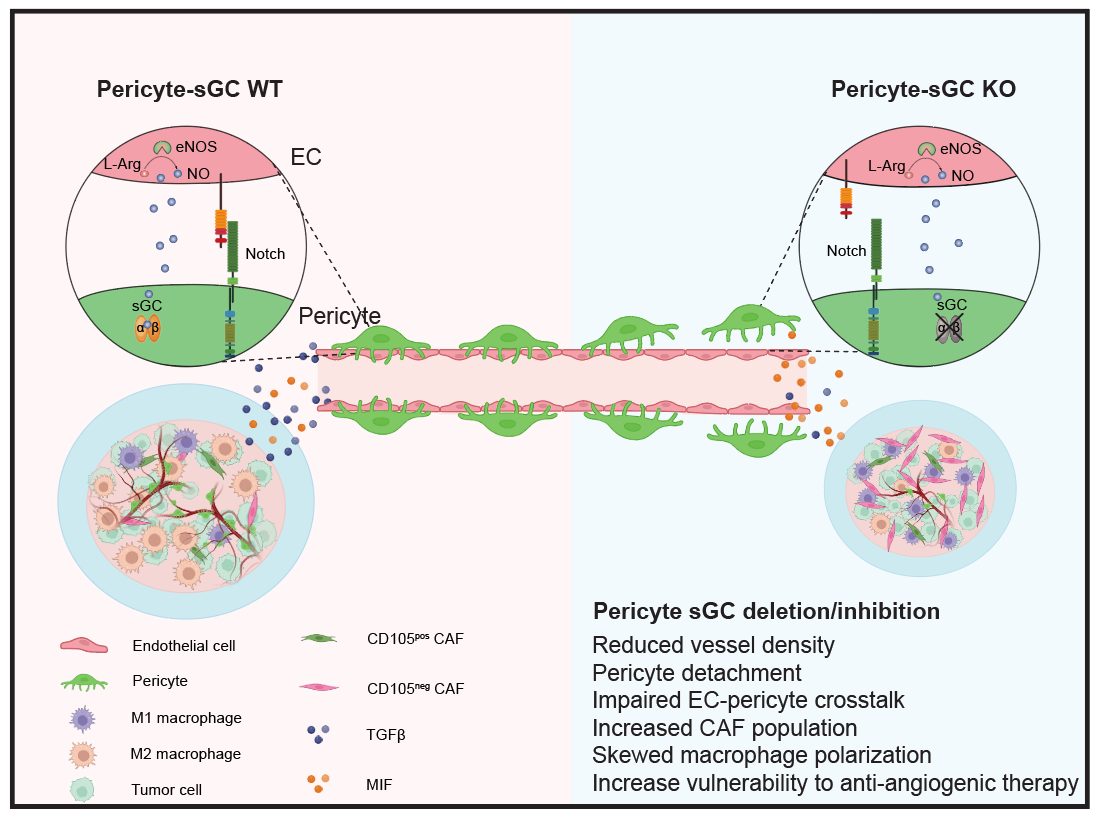
综上所述,本研究揭示了周细胞sGC在调控肿瘤血管新生和微环境塑造中的重要作用,深化了对肿瘤周细胞和NO-sGC信号通路功能的理解。同时,发现了sGC抑制剂可以显著提高VEGFR抑制剂抑制肿瘤生长的疗效,为增强临床抗血管新生肿瘤疗法的提供了新的策略。
中国科学院上海有机化学研究所生物与化学交叉研究中心博士研究生朱静,杨伍博士,何浩博士,上海营养与健康研究所博士研究生马键赟,临港实验室助理研究员刘振博士为该论文共同第一作者。生物与化学交叉研究中心胡军浩研究员和杨伍博士、临港实验室魏武研究员为共同通讯作者。本研究得到了国家自然科学基金、中国科学院、上海市科委等项目的资助。
附件下载:



