Cancer Discovery | 临港实验室合作揭示KRAS突变型肝内胆管癌的治疗新策略
肝内胆管癌(intrahepatic cholangiocarcinoma,iCCA) 是常见的原发性肝癌之一。近年来,研究者基于临床大样本的多组学研究,从iCCA起源及肿瘤微环境异质性等角度对iCCA进行了系统的解析。先后提出了以蛋白组为核心的iCCA分子分型及以转录组为核心的免疫分型,并初步明确KRAS突变是iCCA炎症亚型的主要驱动因素之一。炎症不仅可以促进肿瘤的发生发展,而且严重影响免疫治疗疗效。然而,KRAS突变如何影响iCCA中炎症的分子机制尚不清楚。值得关注的是,越来越多的研究支持可变剪接(alternative splicing,AS)在炎症反应过程中扮演着重要的角色。AS是重要的转录后过程之一,前体RNA发生AS可以产生转录的多样性 。因此,在iCCA中进行AS相关的转录组学研究,有助于深入了解KRAS突变型iCCA的炎症相关发病机制,从而为KRAS突变型iCCA的诊疗提供更加有效的方案。
2023年7月24日,临港实验室魏武研究员团队联合复旦大学附属中山医院樊嘉院士团队高强教授、林健博士,在 Cancer Discovery 上发表题为 An inflammatory checkpoint generated by IL1RN splicing offers therapeutic opportunity for KRAS mutant intrahepatic cholangiocarcinoma 的研究论文。

研究者基于大量的组学数据,全面描绘了iCCA中可变剪接事件(alternative splicing events,ASEs)景观。并整合单细胞转录组测序、多色免疫荧光和多因子检测等技术,从细胞系、类器官、小鼠模型以及临床样本等多个维度,深入探索了KRAS突变型iCCA中IL1RN剪接产生的新型炎症检查点的功能及具体作用机制,这为开发全新的治疗策略提供了理论基础。
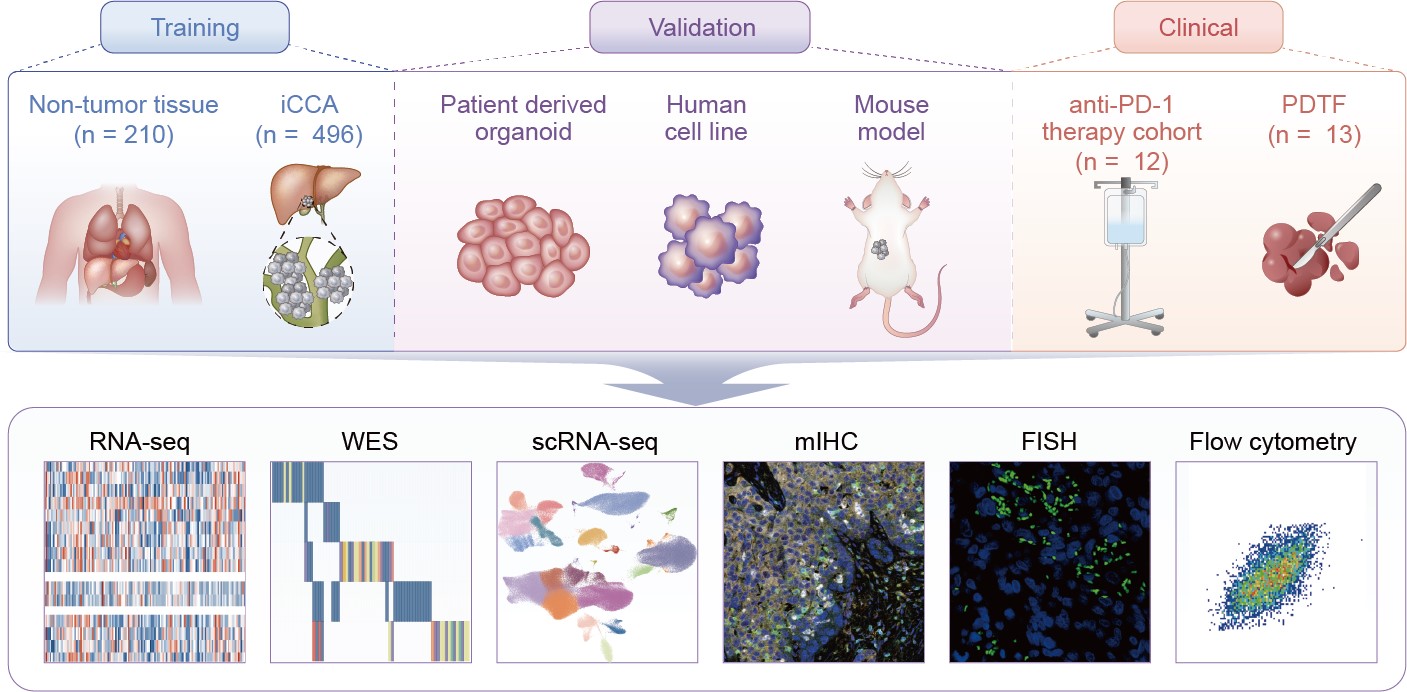
研究设计示意图
在这项工作中,研究者基于496个iCCA样本,22个邻近非肿瘤肝脏样本和188个各类正常组织样本的RNA-seq数据,先后定义了iCCA中231,808个高置信度ASEs及319个与预后相关的肿瘤特异性ASEs。随后,研究者发现KRAS突变可以介导ERK1/2信号的激活,一方面通过分泌CXCL3募集中性粒细胞,另一方面抑制剪接因子TFIP11的表达。而TFIP11的抑制则会导致关键ASE(IL1RN_MX)的PSI值上调,即异构体IL1RN-201/203不同程度的表达增加,这可以通过负反馈调控KRAS突变型iCCA中异常的ERK1/2信号通路来发挥潜在抗炎作用。
为了评估异构体IL1RN-201/203在体内的作用,研究者构建了四种Krt7和Krt19阳性的iCCA小鼠模型。首先,在iCCA小鼠模型中,研究者观察到了前述临床样本中存在的负反馈现象。并揭示了IL1RN-201/203可通过重塑KRAS突变型iCCA小鼠肿瘤的炎症环境,抑制肿瘤进展并延长其生存。具体而言,在KRAS突变型iCCA小鼠中过表达IL1RN-201/203可以导致细胞毒性细胞(如GZMB+ CD8+ T细胞)的显著富集,并伴随着免疫抑制性中性粒细胞群体的减少和重编程。而在KRAS突变型iCCA小鼠中,白介素1受体拮抗剂Anakinra(一种具有抗炎作用的经典药物)同样具有和过表达IL1RN-201/203类似的抑癌作用和机制改变,这个发现为开发更有效的治疗策略提供了新思路。
最后,研究者发现在KRAS突变型iCCA中,PD-1单抗联合Anakinra治疗可以通过进一步降低瘤内中性粒细胞浸润并促进瘤内Gzmb+ Cd8+ T细胞的浸润和活化,以抑制肿瘤进展并改善生存。此外,在KRAS突变型iCCA患者中,基于PD-1单抗治疗反应的改善也与IL1RN-201/203表达升高有关。而当PD-1单抗联合Anakinra处理KRAS突变型患者来源性肿瘤组织块(patient-derived tumor fragment,PDTF)时,肿瘤炎症环境会发生与小鼠中类似的变化。
综上,这项工作整合了多种研究手段,全面阐述了iCCA中高度复杂的ASEs景观,并确定了由IL1RN剪接产生的新型炎症检查点的关键作用,这为KRAS突变型iCCA或其他肿瘤有效干预措施的开发及制定提供了坚实的理论基础。
附件下载:



