临港实验室联合上海药物所合作揭示能量感受器AMPK表观调控肺癌转移的新机制
肺癌是历年来死亡率蝉联第一的恶性肿瘤,其死亡率居高不下主要源于其极易发生转移,因此深入研究肺癌转移的发病机理对于肺癌的控制与治疗至关重要。上皮细胞间充质转化(Epithelial-mesenchymal transition,EMT)被认为是癌细胞扩散的关键驱动因素。EMT过程中常伴随着表观遗传学的染色质重塑,以CDH1为代表的上皮基因,从染色质活跃状态(以组蛋白乙酰化H3Kac和甲基化 H3K4me3为标志)转变为稳定抑制状态(以组蛋白甲基化:H3K27me2/3, H3K9me2/3 为标志),从而限制上皮基因的转录和表达,促进EMT发生。因此,靶向表观遗传学修饰是克服肿瘤转移的有效策略。
单磷酸腺苷激活的蛋白激酶AMPK是细胞中重要的能量感受器和调节器,参与调控糖脂代谢、细胞自噬、细胞凋亡等多种生命活动,在包括肿瘤在内的代谢紊乱相关疾病中发挥重要调控作用。但有关AMPK调控肿瘤转移,尤其在表观遗传领域尚且缺少深入研究。
近日,临港实验室臧奕研究员联合上海药物研究所李佳团队以及上海肺科医院施宏医生,共同在国际知名期刊Signal Transduction and Targeted Therapy(IF=38)发表题为“Phosphorylation of PHF2 by AMPK releases the repressive H3K9me2 and inhibits cancer metastasis”的研究论文,揭示代谢调节核心分子AMPK(AMP-activated protein kinase)表观调控H3K9me2抑制肺癌转移的新机制。

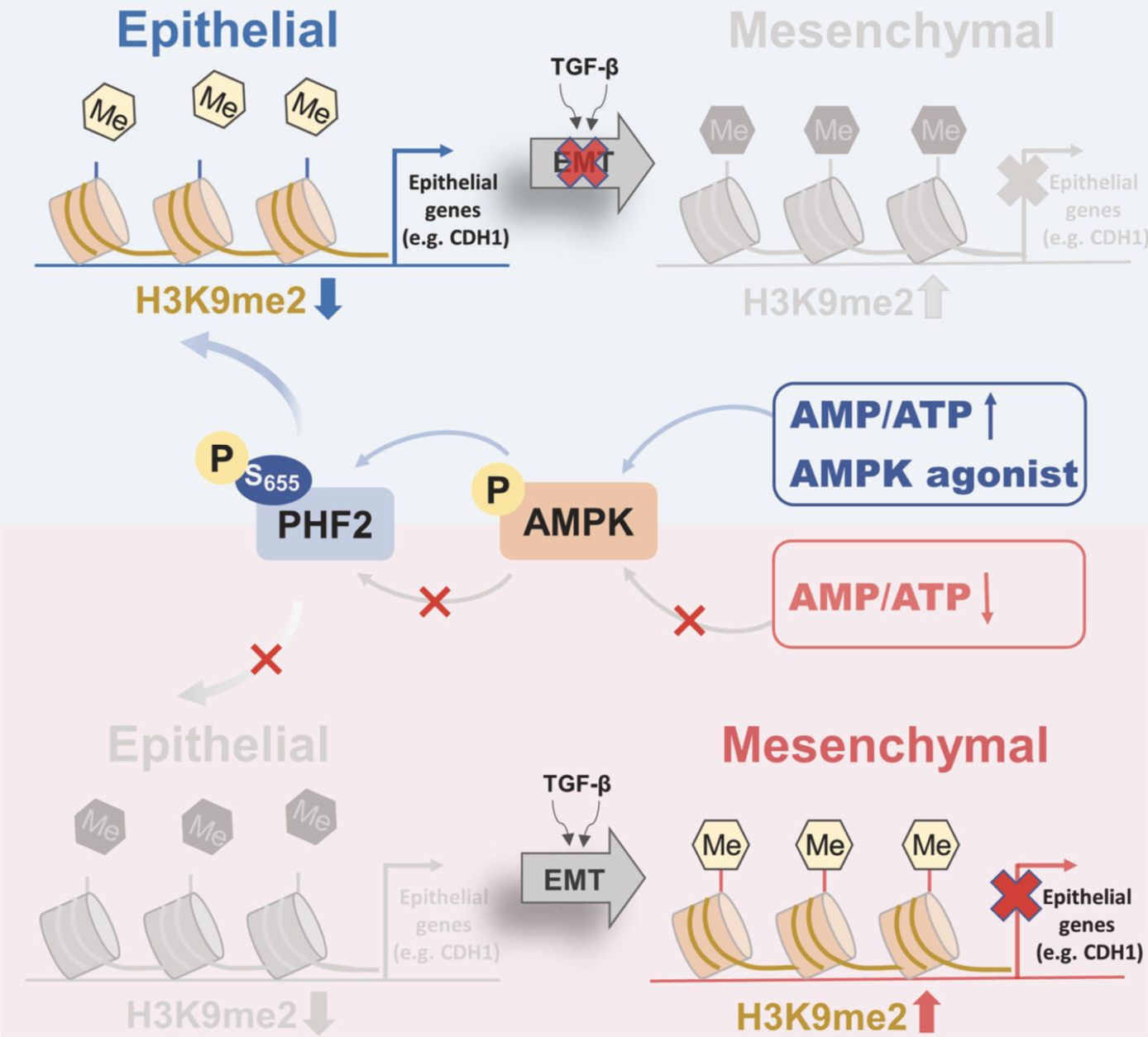
该研究发现利用二甲双胍激活AMPK能够抑制小鼠肺癌转移并下调H3K9me2水平。H3K9me2是经典的转录抑制标志物,也是恶性肿瘤进展中的常见染色质改变。通过机制研究发现作用于H3K9me2位点的组蛋白去甲基酶PHF2是AMPK的下游磷酸化新底物。AMPK通过磷酸化PHF2-S655位点介导其发挥组蛋白去甲基化酶活,减少下游靶基因CDH1启动子区域的H3K9me2富集,从而抑制EMT的发生。且AMPK所介导的PHF2-S655磷酸化水平在临床肺癌中显著降低,具有重要临床意义。
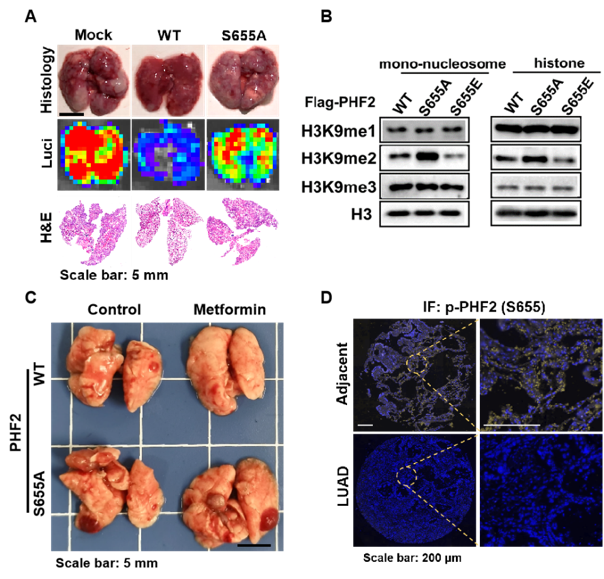
图A. S655A位点突变阻断PHF2抑制肺癌转移;图B. S655E突变促进PHF2发挥组蛋白去甲基化酶活,S655A反之抑制;
图C. S655A突变阻断二甲双胍改善肺癌转移的作用;图D. PHF2-S655磷酸化水平在临床肺癌组织中显著下降。
该研究通过揭示AMPK抑制肺癌转移在表观遗传领域的新底物和新机制,有助于拓宽AMPK的蛋白调控网络,促进二甲双胍的临床应用,并通过发现PHF2-S655磷酸化成为潜在的临床肺癌预后标志物,为肺癌的转移恶化提供新靶标。同时激励着我们后续进一步考察代谢重编程与肿瘤转移之间的相关性。
上海药物研究所的博士后董莹为本文的独立第一作者。上海药物研究所李佳研究员、临港实验室臧奕研究员、上海肺科医院施宏医生为共同通讯作者。该项工作得到了上海药物研究所谭敏佳研究员、黄敏研究员以及临港实验室黄洵研究员的帮助。该项研究获得了国家自然科学基金、中国博士后科学基金、临港实验室、上海市科委扬帆计划、上海市肺科医院人才计划等项目的资助。
附件下载:



